在進行NGS定序之前,樣本需要先製備成Library文庫,而Library QC是「Library」建立後所進行品質檢測 (Quality Control, QC)的方法。目的是為了確認Library文庫的品質與完整性、文庫片段大小是否在預期範圍、文庫有無降解或污染以及文庫正確濃度 (過濃或過稀都會影響定序時cluster與data生成)。
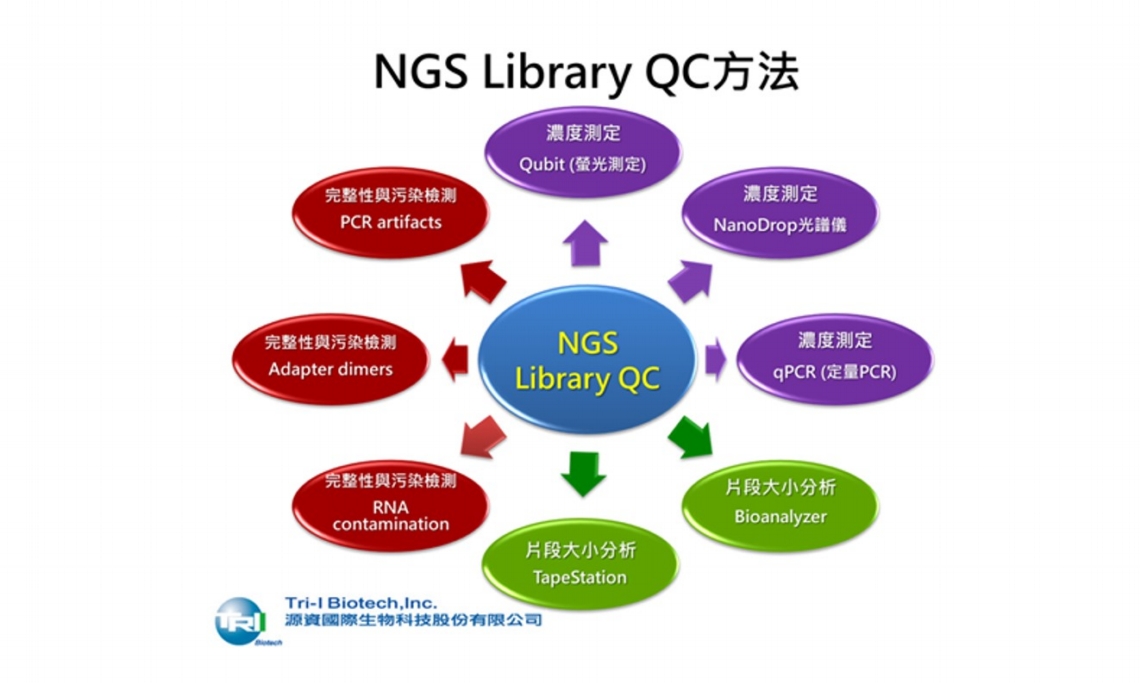
以下為常見的NGS Library QC方法:
1. 濃度測定 (Quantification):
(1) 螢光測定 (Qubit)
優點:精確測量雙股DNA濃度,低濃度也準確。
缺點:不提供片段大小資訊。
(2) 分光光度計測定 (NanoDrop)
優點:快速、簡便。
缺點:容易受RNA或其他污染物干擾,不夠精確。
(3) 定量PCR (qPCR)
優點:可測序列ligation後的有效library濃度。
缺點:成本較高,需標準曲線與專用試劑盒。
2. 片段大小分析 (Size Distribution):
(1) Bioanalyzer (Agilent)
儀器:微流體晶片分析,常見於小量樣本。
特點:精確度高、圖形輸出直觀,費用中等。
(2) TapeStation (Agilent)
儀器:類似Bioanalyzer,但 throughput較高。
特點:自動化程度高,耗材成本較高。
* 片段大小分析重點:圖形呈現通常希望單一主峰、有預期片段大小 (例如300–500 bp)、無明顯primer dimer或過多小分子片段。
3. 完整性與污染檢測:
(1) RNA 殘留:使用Bioanalyzer的RNA分析或NanoDrop A260/A280比值觀察。
(2) Library adapter dimers:大小約120–150 bp,應該被最小化或移除。
(3) 非專一性PCR產物 (PCR artifacts) :檢測是否有非特異性擴增。
總結來說:
1. 進行NGS library QC是確保高品質數據與降低失敗率的重要步驟。建議多種方法搭配使用,例如:定量 (qPCR)+片段分析 (Bioanalyzer)進行雙重確認。
2. 一般常見QC合格標準建議:
(1) Library濃度 (qPCR):>10 nM (依定序平台可能不同)。
(2) 平均片段大小:約300–500 bp (Illumina平台常見)(依實驗目的可能不同)。
(3) 無明顯雙峰或dimer:單一主峰為佳 (依實驗設計可能不同)。
(4) 濃度偏差CV值 (多樣本間):<20%為理想。
# NGS_Library_QC
# Qubit
# NanoDrop
# qPCR
Next Generation Sequencing (NGS) Sequencing Service
1. Nanopore and Illumina offer a complete range of sequencing platforms for long and short sequences.
2. An excellent choice for high efficiency and quality.
3. Professional sample quality control processes and library preparation.
4. Professional bioinformatics analysis and service consultation.