21 CFR Part 11法規意即美國《聯邦管制法規》(Code of Federal Regulations, CFR) 第21章中的US FDA Part 11,內容說明監管電子紀錄與電子簽名的要求,於1997年公佈,並自1999年開始實施,目的為監管製藥業、生物技術及醫療器材製造廠商之所有管理紀錄,包含電子紀錄,以確保安全性、準確性以及可追溯性。
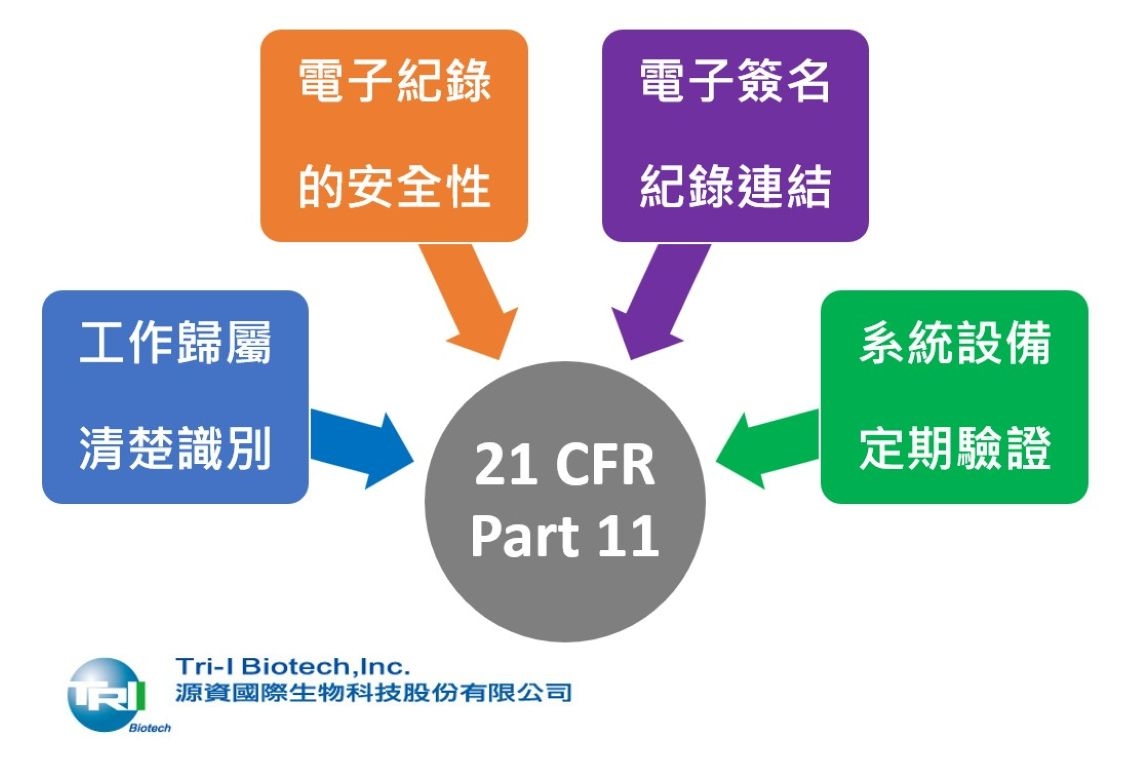
21 CFR Part 11監管實驗室作業包含以下四項要素:
一、電子紀錄的安全性:
使適當人員具有存取正確資訊的適當權限,且必須能夠驗證使用者的身份,並限制只有受過訓練並且獲得授權的人員才能存取系統。由於實驗室人員會根據工作分配而有不同職責,因此必須將資料存取加以隔離與定義,使得特定使用者對於特定資料集具有特定存取權限。
二、工作歸屬:
指的是將執行工作的「人、事、時、地、原因」紀錄下來,將實驗室人員與他們執行的工作建立連結,以下列點說明。
1. 人:須可清楚識別建立、修改或刪除紀錄等特別動作的人員權限。
2. 事:包括紀錄中所包含原有的數值與修改後的數值。
3. 時:明確宣告動作發生的日期與時間。
4. 地:清楚標示紀錄被修改的位置。
5. 原因:說明變更紀錄的原因。
三、電子簽名:
系統必須確保該電子簽名與其關聯的紀錄連結,且無法修改或撤銷,並顯示簽名者的全名、日期與時間,以及簽名的意義或原因(例如職責、執行人員、審查、核准)。
四、系統、設備驗證:
透過IQ/OQ/PQ,分別是Installation Qualification(安裝驗證)、Operation Qualification(操作驗證)、Performance Qualification(性能驗證)以確保系統或設備值得信賴,定期執行和紀錄驗證活動、在重大更新後重新驗證並保存詳細的驗證紀錄。
1. IQ:Installation Qualification(安裝驗證)
為證明所安裝或修正的設施、系統與設備,能符合其所核准的原廠之建議。
2. OQ:Operation Qualification(操作驗證)
確認所安裝或更新的設施、系統及設備,在其預期的操作範圍內的運轉。
3. PQ:Performance Qualification(性能驗證)
依其所核准的製程、方法、規格為基礎,確認設施、系統及設備為有效且具再現性。
#21 CFR Part 11
#實驗室品管
#源資生物科技核酸實驗室
#TriIBiotech
Next Generation Sequencing (NGS) Sequencing Service
1. Nanopore and Illumina offer a complete range of sequencing platforms for long and short sequences.
2. An excellent choice for high efficiency and quality.
3. Professional sample quality control processes and library preparation.
4. Professional bioinformatics analysis and service consultation.